A.V. Herrera-Herrera, and al. ont réalisé une revue bibliographique couvrant les années  2009-2011 (242 références). Cette revue donne une large vision de l’utilisation des nanotubes de carbone, et de leurs applications les plus récentes en chimie analytique. Ils se sont particulièrement attardés à leurs utilisations en chromatographie, en SPE/SPME (Solid Phase Extraction / Solid Phase Micro-Extraction), et en EC/EKC (électrophorèse capillaire / électrophorèse capillaire cinétique). Comme nous l’avons vu dans un article précédent (Post du 19.04.12), les nanotubes de carbone peuvent être fonctionnalisés. Ils peuvent également stocker des molécules « hôtes » dans leur cavité intérieure, cette propriété est utilisée pour les extractions de métaux.
2009-2011 (242 références). Cette revue donne une large vision de l’utilisation des nanotubes de carbone, et de leurs applications les plus récentes en chimie analytique. Ils se sont particulièrement attardés à leurs utilisations en chromatographie, en SPE/SPME (Solid Phase Extraction / Solid Phase Micro-Extraction), et en EC/EKC (électrophorèse capillaire / électrophorèse capillaire cinétique). Comme nous l’avons vu dans un article précédent (Post du 19.04.12), les nanotubes de carbone peuvent être fonctionnalisés. Ils peuvent également stocker des molécules « hôtes » dans leur cavité intérieure, cette propriété est utilisée pour les extractions de métaux.
Durée de péremption des réactifs après ouverture? (1) – Commission SFSTP
Exigence règlementaire, la gestion des péremptions des réactifs dans les laboratoires d’analyse est souvent traitée sans réel argument scientifique. Les dates de péremption indiquées par les fournisseurs ne sont bien souvent valables qu’en cas de récipient resté fermé.
fermé.
En cas d’ouverture multiples, que peut-on dire de la conservation de l’intégrité des substances ? Et quel peut être l’impact de cette substance sur la fiabilité des résultats d’analyse ?
C’est à ces questions que la commission SFSTP a tenté de répondre en proposant une méthodologie basée sur l’analyse du risque.
Colonnes sub 2 µm: poreuse ou core-shell !
Comme nous l’avions vu dans un article précédent (Post du 4.06.12 ), Phenomenex est, à ce jour, le seul fournisseur à proposer des colonnes Core-shell pour des granulométries inférieures à 2 µm.
Il est donc intéressant de voir si, dans ce domaine de taille, il subsiste une différence significative entre cette phase à noyau dur et les phases poreuses proposées par d’autres fournisseurs.
Pour avancer sur cette comparaison, nous présentons ici les résultats d’un test des performances d’une colonne core-shell Sub 2 µm et d’une colonne poreuse Sub 2 µm pour l’analyse UHPLC d’un échantillon d’oligosaccharide thérapeutique (C95H143N11O59S8Na8 – Mw = 2823 g/mol).
HPLC: Rétention d’un composé au volume mort ?
Un article du Journal of Chemistry Volume 2013 (2013), Hindawi Ed.
RP-HPLC Method Development and Validation for Simultaneous Estimation of Three Drugs: Glimepiride, Pioglitazone, and Metformin and Its Pharmaceutical Dosage Forms
attire une remarque sur la rétention du composé Metformine et interpelle sur les fondamentaux de l’HPLC.
En effet le temps de rétention du composé est présenté à 1,34 min. Ce temps doit être supérieur au volume mort de la colonne pour témoigner de l’existence d’une rétention significative du composé.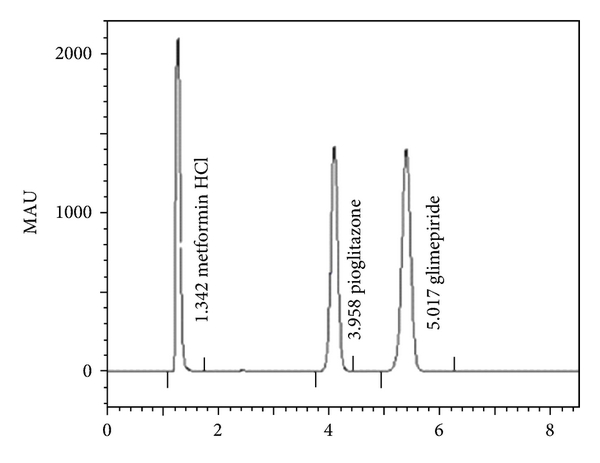
La colonne utilisée est une Inertsil ODS-3 V – 250 mm × 4.6 mm, 5 μm porosité 100A. Le volume mort estimé à l’aide des caractéristique de la colonne pour un débit de 1,7 ml/min est de 1,55 min. Le temps de rétention du composé Metformine est donc inférieur au volume mort de la colonne: peut-on considérer dans ce cas que le composé répond à un mécanisme chromatographique ?
Les résultats de la validation de la méthode sur ce composé sont acceptables et ne permettent pas de détecter cette anomalie chromatographique. Ne faut-il pas dans ce cas introduire le détermination du facteur de capacite (K = (Tr-Tm)/Tm ) dans l’étude de la spécificité qui serait « négatif » pour ce composé et matérialiserait l’absence de rétention.
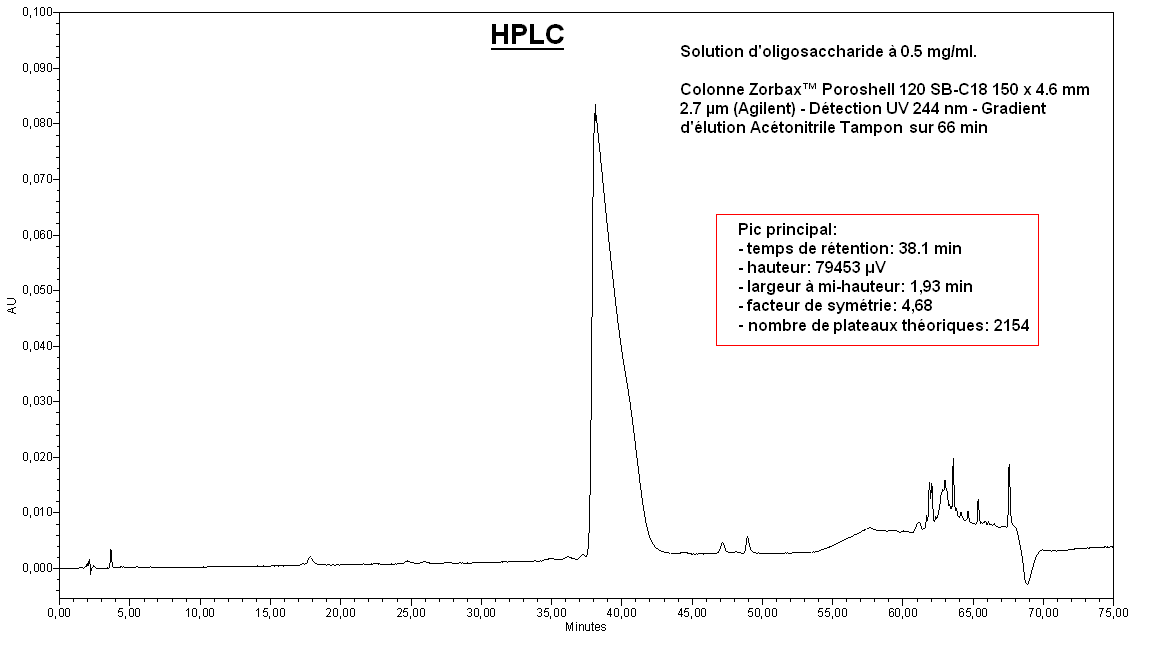
Apport de l’UHPLC pour l’analyse d’oligosaccharides thérapeutiques
Nous avons évalué l’intérêt de l’UHPLC pour l’analyse d’un oligosaccharide thérapeutique (C95H143N11O59S8Na8 – Mw = 2823 g/mol) par rapport à l’analyse de cette même molécule en HPLC.
L’échantillon est constiuté d’une solution d’oligosaccharide à 0.5 mg/ml.
L’analyse HPLC est réalisée sur une colonne Zorbax™ Poroshell 120 SB-C18 150 x 4.6 mm 2.7 µm (Agilent) – Détection UV 244 nm – Gradient d’élution Acétonitrile/Tampon sur 66 min.