L’essentiel de la littérature sur l’analyse du miel concerne le dosage des sucres simples (glucose, fructose). Les données relatives à l’analyse des sucres complexes sont plus rares alors que ces composés sont essentiels dans la détermination de l’origine du miel.
Nous nous sommes donc intéressés à l’évaluation de l’Electrophorèse Capillaire pour l’analyse complète du miel (sucres simples et sucres complexes).
L’intérêt de l’électrophorèse capillaire réside sur une mise en oeuvre simple de l’échantillon (dilution dans l’eau), une détection UV à 270 nm, et l’absence d’interférence des molécules majoritaires (glucose, fructose) sur la détection des autres carbohydrates minoritaires. Les sucres chargés en milieu basique sont séparés sur un capillaire de 60 cm dans un électrolyte d’hydroxyde de sodium.
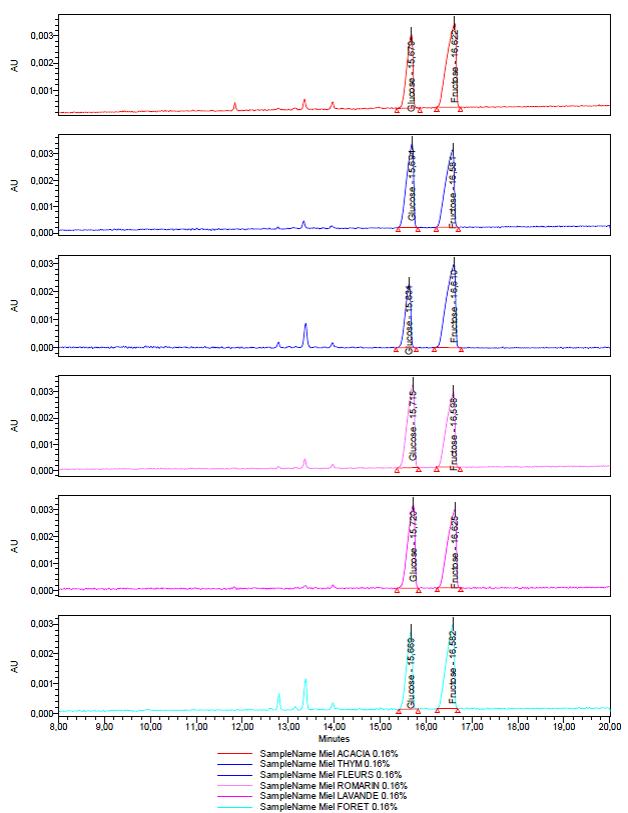
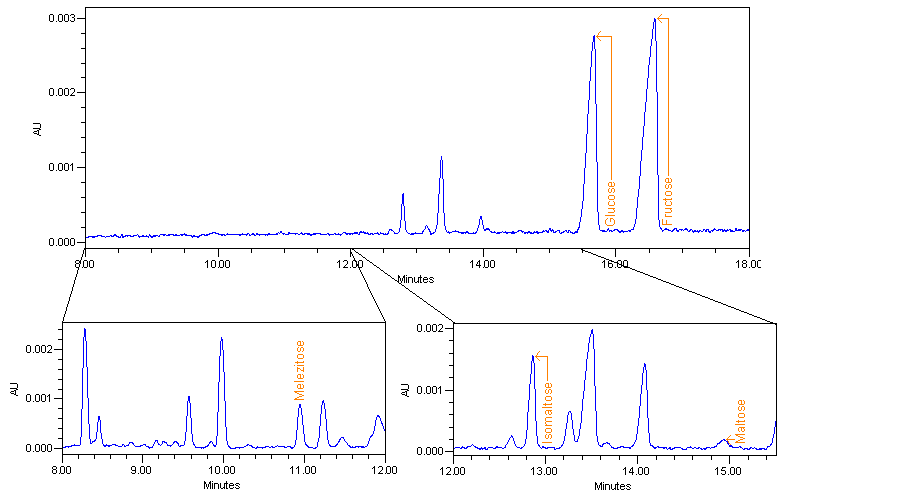 Les électrophérogrammes montrent trois zones d’intérêt 8-12 min et 12-15 min pour la recherche des sucres complexes, 15-18 min pour le dosage du glucose et fructose.
Les électrophérogrammes montrent trois zones d’intérêt 8-12 min et 12-15 min pour la recherche des sucres complexes, 15-18 min pour le dosage du glucose et fructose.
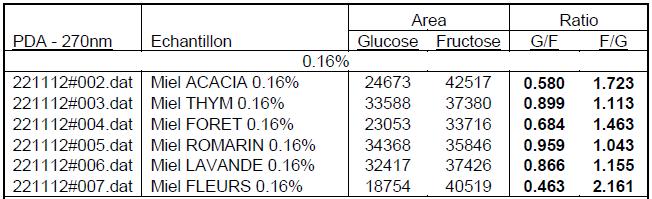
6 miels du commerce (acacia, thym, toutes fleurs, romarin, lavande et forêt) ont été analysés dans ces conditions. Une dilution à 0,16 % m/v dans l’eau permet de quantifier le glucose et le fructose par le relevé des surfaces et la détermination du ratio entre les deux carbohydrates. On peut observer des différences très significatives en fonction de l’origine des échantillons.
 En augmentant la concentration des échantillons injectés (0.5%) pour la zone de 12 à 15 min et (4%) pour la zone de 8 à 12 min il est possible de détecter plusieurs composés parmi lesquels le mélézitose, l’isomaltose, le maltose, le sucrose et le tréhalose ont été identifiés. Les profils obtenus sont tous différents et caractéristiques de chaque échantillon de miel testé.
En augmentant la concentration des échantillons injectés (0.5%) pour la zone de 12 à 15 min et (4%) pour la zone de 8 à 12 min il est possible de détecter plusieurs composés parmi lesquels le mélézitose, l’isomaltose, le maltose, le sucrose et le tréhalose ont été identifiés. Les profils obtenus sont tous différents et caractéristiques de chaque échantillon de miel testé.
L’analyse des carbohydrates par Electrophorèse Capillaire est d’un grand intérêt pour la détermination de la composition du miel. Elle se différencie nettement des autres techniques (chromatographiques) par sa facilité de mise en oeuvre. Elle permet de s’affranchir de la dérivatisation de l’échantillon et des systèmes de détection réfractométrique ou à diffusion de lumière.
Note: Travaux réalisés avec les tampons du CEofixTMCarbo kit (PN B20754) sur un PA 800plus (BeckmanCoulter) équipé d’un détecteur à barrettes de diode (DAD).
Bibliographie:(1) Stella Rovio, Jari Yli-Kauhaluoma, and Heli Sirén, Determination of neutral carbohydrates by CZE with direct UV detection, Electrophoresis (2007), 28, 3129 -3135.(2) Stella Rovio, Helena Simolin, Krista Koljonen, and Heli Sirén, Determination of monosaccharide composition in plant fiber materials by capillary zone electrophoresis, J.Chromatogr. A (2008), 1185, 139 – 144.
(3) Cédric Sarazin, Nathalie Delaunay, Christine Costanza, Véronique Eudes, Pierre Gareil, Jérôme Vial, On the use of response surface strategy to elucidate the electrophoretic migration of carbohydrates and optimize their separation, J Sep Sci. (2012), 35(10-11) ,1351-8.